Zadanie 7.2.1.8
Wskazówka teoretyczna
I. Masa wydzielającej się substancji \(m\) jest proporcjonalna do przepływającego przez elektrolit ładunku \(Q\).
\[m=kQ=kIt\]
gdzie \(k\) jest stałą zwaną równoważnikiem elektrochemicznym, równym liczbowo masie wydzielonej przy przepływie przez elektrolit ładunku \(1\) kulomba w czasie \(1\) sekundy. Jednostka to \(\displaystyle{\mathrm{\frac{kg}{As}} }\).
II. Równoważniki elektrochemiczne \(k\) pierwiastków są proporcjonalne do ich równoważników chemicznych.
\[\displaystyle{k=\frac{1}{F}\frac{M}{w_i} }\]
gdzie \(F\) jest stałą Faradaya. \(M\) jest masą jonu, a \(w_i\) to wartościowość jonu.
Informacja
Postaraj się samodzielnie rozwiązać zadanie. Możesz sprawdzić swój tok rozumowania, klikając w przyciski odsłaniające kolejne etapy proponowanego rozwiązania lub sprawdź od razu odpowiedź.
Dane i szukane
Dane:
- moc prądu elektrycznego \(P=10\,\mathrm{W}\),
- czas w jakim na elektrodzie wydzielał się wodór \(t=20\,\mathrm{min}=1200\,\mathrm{s}\),
- masa wydzielonego wodoru \(m=0,4\,\mathrm{g}=4\cdot 10^{-4}\,\mathrm{kg} \),
- stała Faradaya \(\displaystyle{F=9,65\cdot 10^4\,\mathrm{\frac{C}{mol} }}\),
- masa molowa jednego kilograma wodoru \(\displaystyle{\mu_H=1\,\mathrm{\frac{kg}{mol} }}\).
Szukane:
-opór elektryczny elektrolitu \(R\).
Analiza sytuacji
W roztworze wodnym \(\mathrm{H_2SO_4}\) następuje dysocjacja elektrolityczna
\[\mathrm{H_2SO_4\rightarrow 2H^{1+}+SO_4^{2-}}\]
dzięki której może płynąć przez elektrolit prąd, przy czym jednowartościowe kationy \(H^+\) kierują się do katody \(K\), a dwuwartościowe aniony \(SO_4^{2-}\) kierują się do anody \(A\). Na katodzie, w trakcie przepływu prądu, będzie wydzielać się wodór.
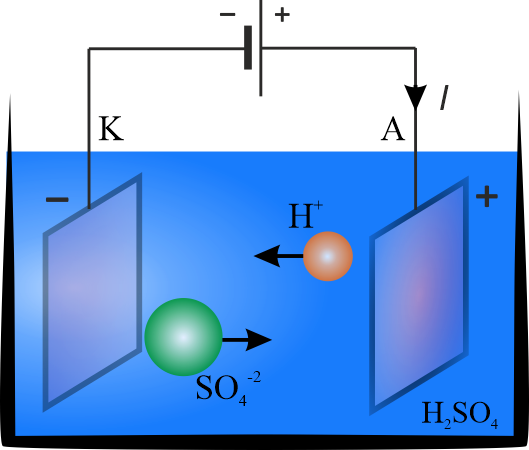
Opór elektryczny \(R\) elektrolitu wyznaczymy z zależności \(P=UI=I^2R\). Natężenie prądu występuje w I prawie Faradaya \(m=kIt\), a równoważnik elektrochemiczny \(k\) można wyznaczyć korzystając z II prawa Faradaya \(\displaystyle{k=\frac{\mu_H}{F} }\) (wartościowość wodoru wynosi 1, czyli \(w_i=1\)).
Podsumowując, można zapisać
\[\displaystyle{I=\frac{m}{kt}=\frac{mF}{\mu_Ht} }\]
\[\displaystyle{R=\frac{P}{I^2}=\frac{P\cdot \mu_H^2\cdot t^2}{m^2F^2} }\]
Rozwiązanie
Szukany opór wynosi:
\[\displaystyle{R=\frac{P\cdot \mu_H^2\cdot t^2}{m^2F^2}}\]
\[\displaystyle{R=\frac{10\cdot 1\cdot 1200^2}{\left (4\cdot 10^{-4} \right )^2\cdot \left (9,65\cdot 10^4\right )^2}= 9665\,\Omega}\]
Odpowiedź
Ppór elektryczny elektrolitu wynosi \(R=9665\,\Omega\).
